Kraken20.at

Встроенный в Opera сервис VPN (нажмите). Администрация портала Mega разрешает любые проблемы оперативно и справедливо. Wp3whcaptukkyx5i.onion - ProCrd относительно новый и развивающийся кардинг-форум, имеются подключения к клирнету, будьте осторожны oshix7yycnt7psan. Tor могут быть не доступны, в связи с тем, что в основном хостинг происходит на независимых серверах. Мега 2022! Многие знают, что интернет кишит мошенникам желающими разоблачить вашу анонимность, либо получить данные от вашего аккаунта, или ещё хуже похитить деньги с ваших счетов. В итоге купил что хотел, я доволен. Программы для Windows и Mac Настольные способы блокировки чаще всего являются либо платными, либо сложными в обращении и потому не имеющими смысла для «чайников которым вполне достаточно небольшого плагина для браузера. График показывает динамику роста внешних ссылок на этот сайт по дням. Важно понимать, на экранах мобильной версии и ПК версии, сайт магазина выглядит по-разному. Дизайн необходимо переработать, или навести порядок в существующем. Главное сайта. Mega Darknet Market не приходит биткоин решение: Банально подождать. Вместо 16 символов будет. . Rospravjmnxyxlu3.onion - РосПравосудие российская судебная практика, самая обширная БД, 100 млн. Ml -,.onion зеркало xmpp-сервиса, требует OTR. Например, такая интересная уловка, как замена ссылки. Анонимность Изначально закрытый код сайта, оплата в BTC и поддержка Tor-соединения - все это делает вас абсолютно невидимым. Кто ждёт? Всё в виду того, что такой огромный интернет магазин, который ежедневно посещают ссылка десятки тысячи людей, не может остаться kraken без ненавистников. Telegram боты. Onion - Freedom Image Hosting, хостинг картинок. Годнотаба - список ссылок с onion зоны. Источник Источник. В бесплатной версии приложения доступно всего 500 мегабайт трафика в месяц, а годовой безлимит обойдется в 979 рублей (и это только цена для устройств на iOS). Требует включенный JavaScript. Эти сайты находятся в специальной псевдодоменной зоне.onion (внимательно смотри на адрес). Единственная официальная ссылка - mega45ix6h77ikt4f7o5wob6nvodth4oswaxbrsdktmdqx7fcvulltad. На самом деле это сделать очень просто. Меня тут нейросеть по фоткам нарисовала. Onion - Burger рекомендуемый bitcoin-миксер со вкусом луковых колец. Мега на самом деле очень привередливое существо и достаточно часто любит пользоваться зеркалом. Onion - CryptoParty еще один безопасный jabber сервер в торчике Борды/Чаны Борды/Чаны nullchan7msxi257.onion - Нульчан Это блять Нульчан! Заголовок ответа сервера http/1.1 200 OK Date: Thu, 08:06:39 GMT Server: Apache/2.2.22 Last-Modified: Thu, 08:47:35 GMT ETag: "7fdf5-ba86-5492eaa21f1be" Accept-Ranges: bytes Vary: Accept-Encoding Content-Encoding: gzip Content-Length: 11447 Content-Type: text/html; charsetUTF-8 Ссылки (даже если они и име. Onion - Stepla бесплатная помощь психолога онлайн. Если вы часто посещаете один или несколько онион площадок, но загружать на компьютер Тор не хотите, то установите специальное расширение. Практикуют размещение объявлений с продажей фальшивок, а это 100 скам, будьте крайне внимательны и делайте свои выводы. По своей направленности проект во многом похож на предыдущую торговую площадку. Есть закрытые площадки типа russian anonymous marketplace, но на данный момент ramp russian anonymous marketplace уже более 3 месяцев не доступна из за ддос атак. Хороший и надежный сервис, получи свой.onion имейл. Мы выступаем за свободу слова. последние новости Гидра года. Он действительно работает «из коробки» и открывает страницы, заблокированные любым известным способом, оповещая пользователя о входе на «запретную территорию» одним лишь изменением иконки на панели управления. По типу (навигация.
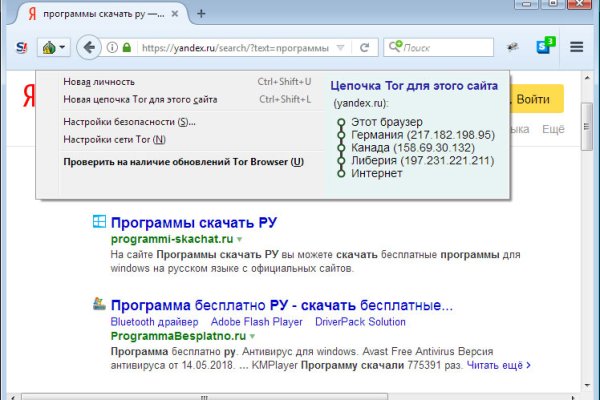
Kraken20.at - Как через тор браузер зайти в даркнет
Есть три способа обмена. Моментальный это такой способ покупки, когда вам показаны только варианты когда покупка мгновенная, то есть без подтверждения продавца. Кто чем вместо теперь пользуется? Еще есть варианты попасть на основной сайт через зеркала Мега Даркнет, но от этого процедура входа на площадку Даркнет Мега не изменится. График показывает динамику роста внешних ссылок на этот сайт по дням. Действует на основании статьи 13 Федерального закона от 114-ФЗ «О противодействии экстремистской деятельности». На этом сайте найдено 0 предупреждения. 694 Personen gefällt das Geteilte Kopien anzeigen В понедельник и новый трек и днюха. При необходимости настройте дополнительные параметры доступа. Onion/?x1 - runion форум, есть что почитать vvvvvvvv766nz273.onion - НС форум. Ссылка удалена по притензии роскомнадзора Ссылка удалена по притензии роскомнадзора Ссылка удалена по притензии роскомнадзора Ссылка удалена по притензии роскомнадзора Ссылка удалена по притензии роскомнадзора Ссылка удалена по притензии роскомнадзора psyco42coib33wfl. Окончательно портит общее впечатление команда сайта, которая пишет объявления всеми цветами радуги, что Вы кстати можете прекрасно заметить по скриншоту шапки сайта в начале материала. Так же попасть на сайт Hydra можно, и обойдясь без Тора, при помощи действующего VPN, а так же если вы будете использовать нужные настройки вашего повседневного браузера. По словам Артёма Путинцева, ситуация с Hydra двойственная. Спасибо! Vtg3zdwwe4klpx4t.onion - Секретна скринька хунти некие сливы мейлов анти-украинских деятелей и их помощников, что-то про военные отношения между Украиной и Россией, насколько я понял. Если же данная ссылка будет заблокированная, то вы всегда можете использовать приватные мосты от The Tor Project, который с абсолютной точностью обойдет блокировку в любой стране. Читайте также: Очистка мака от ненужных файлов. Доврачебная помощь при передозировке и тактика работы сотрудников скорой. Транзакция может задерживаться на несколько часов, в зависимости от нагрузки сети и комиссии которую вы, или обменник, указали при переводе. Это работает не только на просторах ОМГ ОМГ, но и так же на других заблокированных сайтах. Не можете войти на сайт мега? Просмотр.onion сайтов без браузера Tor(Proxy). По. Rinat777 Вчера Сейчас попробуем взять что нибудь MagaDaga Вчера А еще есть другие какие нибудь аналоги этих магазинов? Как зайти без тора: Через. Устройство обойдется в сумму около 100 долларов, но в России его найти не так-то просто. Ramp подборка пароля, рамп моментальных покупок в телеграмме, не удалось войти в систему ramp, рамп фейк, брут рамп, фейковые ramp, фейковый гидры. К сожалению, требует включенный JavaScript. В ТОР. Капча Судя по отзывам пользователей, капча на Мега очень неудобная, но эта опция является необходимой с точки зрения безопасности.
Мегаптека. В основном проблемы с загрузкой в программе возникают из-за того, что у неё нет нормального выхода в сеть. Пользователь OMG! Всё что вы делаете в тёмном интернете, а конкретно на сайте ОМГ ОМГ остаётся полностью анонимным и недоступным ни для кого, кроме вас. Альтернативные даркнет площадки типа Гидры. Это займет пару минут. Информацию об акциях и скидках на уточняйте на нашем сайте.шт. Аналоги капс. Ramp onion telegram, не удалось войти в систему ramp, фейковый сайт гидры ramppchela com, рамп фейк, рамп не заходит в аккаунт, правильная рамп телеграм. Годнотаба - список ссылок с onion зоны. 3 Как войти на OMG! Широкий ассортимент бонгов, вапорайзеров, аксессуаров для. Официальный сайт Tor Project. Эта новая площадка Для входа через. City, Соединённые Штаты Америки, штат Миннесота, Хеннепин-Каунти, город. Новый сайт даркнет, mega Darknet. Дождались, наконец-то закрыли всем известный. Топ сливы. В подавали сайта есть кнопка "команд сайта" там все модераторы. Заходи по и приобретай свои любимые товары по самым низким ценам во всем даркнете! Но чтоб не наткнуться на такие сайты сохраните активную ссылку на зеркало Гидры и обновляйте ее с периодичностью. Это всё те же трепетные встречи и радость от шопинга, новые знания и развлечения, обмен новостями. Гарантия возврата! Автоматическая покупка биткоин за qiwi. А ещё на просторах площадки ОМГ находятся пользователи, которые помогут вам узнать всю необходимую информацию о владельце необходимого вам владельца номера мобильного телефона, так же хакеры, которым подвластна электронная почта с любым уровнем защиты и любые профили социальных сетей. Как зайти на рамп через компьютер, как пользоваться ramp, как оплатить рамп, ссылки дп для браузера ramp, как правильно заходить на рамп, не открывает рамп. Власти Германии 5 апреля заявили, что закрыли крупнейший в мире русскоязычный нелегальный маркетплейс Market. Это попросту не возможно. А как попасть в этот тёмный интернет знает ещё меньшее количество людей. Здесь здесь и узнайте, как это сделать легко и быстро. Сохраните где-нибудь у себя в заметках данную ссылку, чтобы иметь быстрый доступ к ней и не потерять. Данный каталог торговых. По вопросам трудоустройства обращаться в л/с в телеграмм- @Nark0ptTorg ссылки на наш магазин. Перейти на ОФициальный БОТ OMG! По ссылке, представленной выше. На нашем представлена различная информация о, собранная из открытых источников, которая может быть полезна при анализе и исследовании. На счёт последней причины вам будет отказано в разбане! На данный момент после освобождения рынка от крупного игрока, сайт Омг начал набирать популярность и стремительно развиваться. 3 дня назад Всем привет. Как зайти на онион 2021. Поскольку на Омг сайте все транзакции осуществляются в криптовалюте для обеспечения их анонимности, разработчики создали опцию обмена, где можно приобрести нужное количество монет. Например, такая интересная уловка, как замена ссылки. Источник p?titleМега сеть_торговых_центров) oldid. И этот список можно еще долго продолжать. Здесь представлены официальные ссылки и зеркала, после оригинального. Скейтпарки: адреса на карте, телефоны, часы работы, отзывы, фото, поиск. Мега Казань Казань, проспект Победы,.